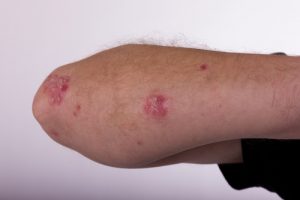
La FDA ha accettato la revisione in via prioritaria della Biologics License Application (BLA) di dupilumab per il trattamento di pazienti adulti affetti da dermatite atopica da moderata a grave, non adeguatamente controllata. A dare la notizia sono Sanofi e Regeneron Pharmaceuticals.
La decisione è attesa per il 29 marzo. Dupilumab è una terapia biologica sperimentale che blocca le interleuchine IL-4 e IL-13, due citochine chiave nella risposta immunitaria di tipo 2 (Th2 compreso), che si ritiene essere il principale fattore nella patogenesi della malattia.
Gli studi a supporto
Il dossier di dupilumab contiene i dati provenienti da tre studi principali di fase 3 del programma clinico LIBERTY AD, che ha coinvolto più di 2.500 pazienti. L’obiettivo degli studi era valutare dupilumab in monoterapia (SOLO 1 e SOLO 2), e in somministrazione concomitante con corticosteroidi topici (CHRONOS), in pazienti adulti con dermatite atopica da moderata a grave, la cui malattia non è adeguatamente controllata con la prescrizione di terapie topiche. Nel 2014, l’FDA ha concesso la designazione di breakthrough therapy per dupilumab nel trattamento di pazienti adulti con dermatite atopica da moderata a grave non adeguatamente controllati, con la prescrizione di terapie topiche o per i quali questi trattamenti non sono appropriati. Dupilumab è attualmente in sviluppo clinico e la sua sicurezza ed efficacia non sono state ancora completamente verificate da nessuna autorità regolatoria. Una volta approvato, dupilumab verrà commercializzato da Regeneron e Sanofi Genzyme.