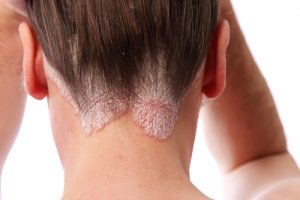
La Commissione Europea (CE) ha concesso l’autorizzazione alla commercializzazione di bimekizumab per
il trattamento della psoriasi a placche da moderata a grave negli adulti candidati alla terapia sistemica.
Bimekizumab è il primo trattamento approvato nell’Unione Europea per la psoriasi a placche da moderata
a grave, progettato per inibire selettivamente e direttamente sia IL-17A che IL-17F, due citochine che svolgono
un ruolo chiave nei processi infiammatori.
Bimekizumab è approvato alla dose raccomandata di 320 mg, somministrato con due iniezioni sottocutanee
ogni quattro settimane fino alla settimana 16 e successivamente ogni otto settimane. Per alcuni pazienti con
un peso corporeo ≥120 kg che non hanno raggiunto una clearance cutanea completa alla settimana 16, 320
mg di bimekizumab ogni 4 settimane dopo la settimana 16 possono migliorare ulteriormente la risposta al
trattamento.
“La nostra ambizione è quella di trasformare la vita delle persone che vivono con malattie gravi, e
siamo incredibilmente orgogliosi di portare una nuova opzione di trattamento alle persone che vivono con la
psoriasi a placche da moderata a grave in Europa. Crediamo che bimekizumab abbia il potenziale per
aumentare le aspettative di ciò che il trattamento della psoriasi può offrire”, ha detto Emmanuel Caeymaex,
Executive Vice President, Immunology Solutions and Head of US, UCB.
Un sondaggio trasversale tra i pazienti ha mostrato che almeno il 90% dei pazienti con psoriasi a
placche da moderata a grave attribuisce un alto valore al trattamento in grado di garantire una pelle ‘pulita’, una
risposta duratura e un rapido inizio dell’azione terapeutica. Inoltre, uno studio di real-world ha dimostrato che
ottenere una pelle completamente ‘pulita’ può fare una differenza significativa per l’impatto che la psoriasi ha
sulla qualità della vita correlata alla salute dei pazienti.
“Negli studi di fase 3, i pazienti trattati con bimekizumab hanno raggiunto livelli superiori di clearance
cutanea rispetto a quelli trattati con placebo, adalimumab e ustekinumab e, nello studio di fase 3b, il
trattamento con bimekizumab ha portato a livelli maggiori di clearance cutanea rispetto al secukinumab. In tutti
gli studi, circa il 60% dei pazienti trattati con bimekizumab ha raggiunto la completa clearance della pelle alla
settimana 16 e questa risposta è stata mantenuta fino a un anno” ha detto il professor Richard Warren, Salford
Royal NHS Foundation Trust and The University of Manchester, UK.
L’approvazione è supportata dai risultati positivi di tre studi di fase 3, che hanno valutato l’efficacia e la sicurezza di bimekizumab in 1.480 pazienti con psoriasi a placche da moderata a grave. I risultati completi degli studi di fase 3, BE READY e BE VIVID, sono pubblicati su The Lancet, e i risultati dello studio di fase 3, BE SURE, sono pubblicati su The New England
Journal of Medicine.
L’approvazione della Commissione Europea è valida in tutti i 27 stati membri dell’UE, così come in Islanda,
Liechtenstein e Norvegia. Bimekizumab è attualmente in fase di revisione da parte della Food and Drug
Administration (Fda) degli Stati Uniti per il trattamento di adulti con psoriasi a placche da moderata a grave. Le
revisioni regolatorie sono in corso anche in Australia, Canada, Gran Bretagna e Giappone.