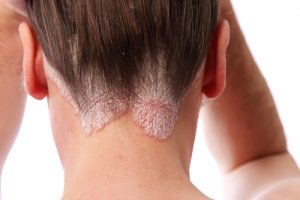
Il Comitato per i medicinali per uso umano (CHMP) dell’EMA ha adottato un parere positivo che raccomanda la concessione dell’autorizzazione alla commercializzazione di Bimzelx (bimekizumab) di UCB, un inibitore sperimentale di IL-17A e IL-17F, per il trattamento della psoriasi a placche da moderata a grave negli adulti che sono candidati alla terapia sistemica.
“Il parere positivo del CHMP è una milestone significativa verso l’approvazione di bimekizumab in Europa. Siamo lieti della decisione di oggi, che riconosce la forza del suo programma di sviluppo clinico nella cura della psoriasi. Bimekizumab testimonia il nostro impegno a far progredire la scienza nell’immunodermatologia, affrontando i bisogni insoddisfatti e migliorando i risultati per i pazienti”, dice Emmanuel Caeymaex, Executive Vice President, Immunology Solutions and Head of U.S., UCB.
L’opinione positiva del CHMP è supportata dai risultati di tre studi di Fase 3 – BE VIVID, BE READY e BE SURE – che hanno valutato l’efficacia e la sicurezza di bimekizumab in adulti con psoriasi a placche da moderata a grave.
Tutti gli studi hanno raggiunto i loro endpoint primari e tutti gli endpoint secondari. I pazienti trattati con bimekizumab hanno raggiunto livelli superiori di clearance cutanea (PASI 90 e IGA 0/1**) alla settimana 16 rispetto a quelli che hanno ricevuto adalimumab, placebo e ustekinumab.
Le risposte cliniche ottenute con bimekizumab alla settimana 16 sono state mantenute fino a un anno in tutti gli studi. Gli eventi avversi riportati più di frequente nei pazienti trattati con bimekizumab sono stati rinofaringite, candidosi orale e infezione del tratto respiratorio superiore .
Se l’autorizzazione alla commercializzazione sarà concessa dalla Commissione Europea, bimekizumab diventerà il primo trattamento approvato per i pazienti con psoriasi a placche da moderata a grave nell’Unione Europea che è progettato per inibire selettivamente e direttamente sia IL-17A che IL-17F, due citochine che svolgono un ruolo chiave nei processi infiammatori